为了保护临床研究受试者的权益和安全,规范医院药物临床试验、医疗器械临床试验的组织管理与运行,保证医疗质量和医疗安全,更好地执行国家发布的《涉及人的生物医学研究伦理审查办法》《药物临床试验质量管理规范》《药物临床试验伦理审查工作指导原则》《医疗器械临床试验质量管理规范》《医疗器械临床试验伦理审查申请与审批表范本》等部门相关法律法规,特制定《厦门弘爱医院临床试验伦理委员会章程》。
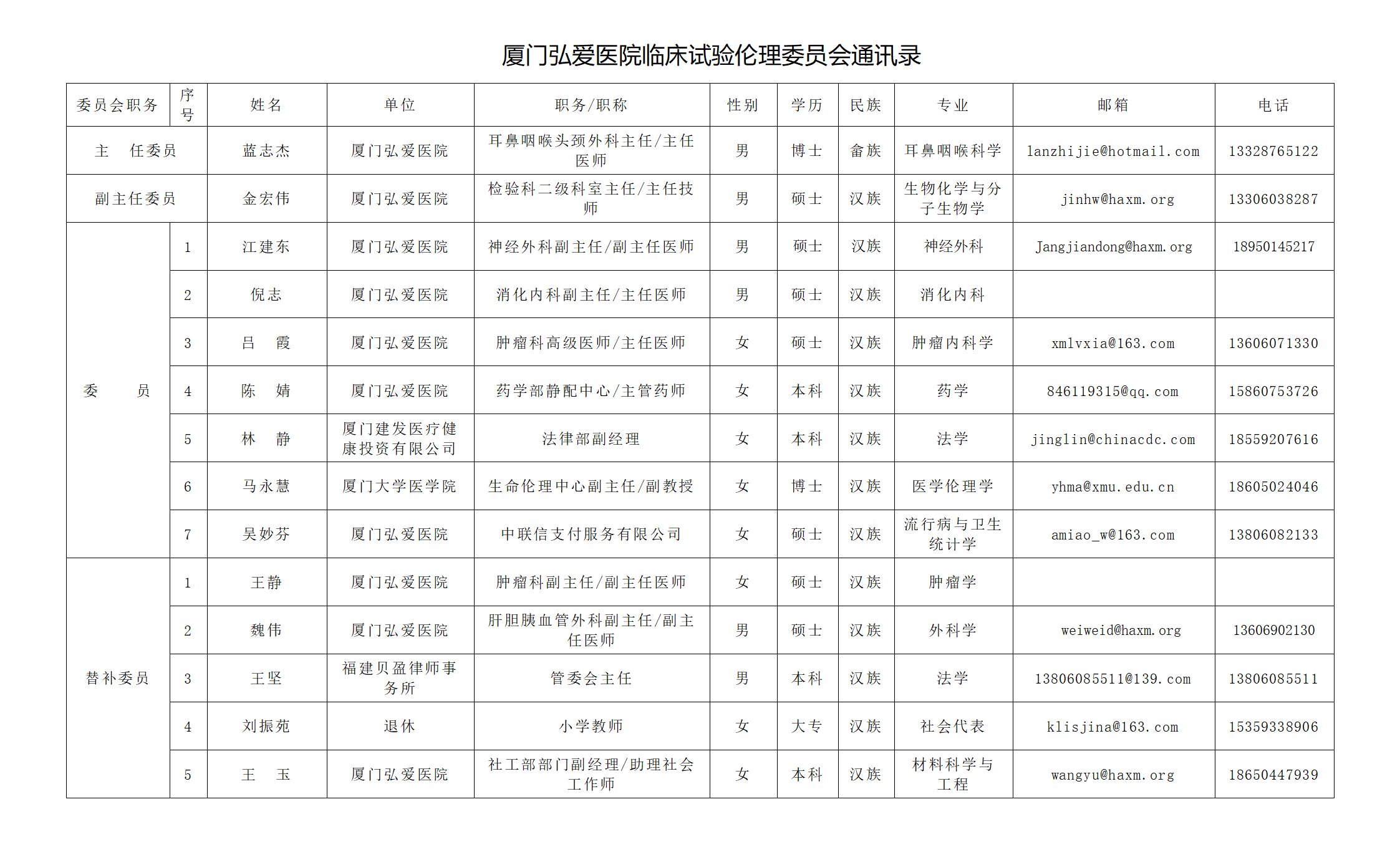
厦门弘爱医院临床试验伦理委员会共有1名主任委员、1名副主任委员,7名委员,5名替补委员;伦理委员会办公室有1名办公室主任,1名办公室秘书。伦理委员会构成符合国家相关法律法规要求,已通过国家药品监督管理局高级研修学院举办的药物GCP培训班、医疗器械GCP培训班、临床试验伦理审查培训班、伦理委员会体系文件培训及其他院内外培训,具备相应的伦理审查能力。伦理委员会设置伦理办公室,负责伦理委员会日常行政事务的管理工作。
厦门弘爱医院临床试验伦理委员会的宗旨:通过对涉及人的生物医学研究项目的伦理审查,确保受试者的权益和安全得到保护促进生物医学研究达到科学和伦理的高标准,增强公众对研究的信任和支持。
- 办事指南 /
- 备案科室介绍 /
- 联系我们
-
同意审查的标准
查看更多附件:
同意审查的标准
2023-02-08 -
厦弘爱﹝2022﹞92号-厦门弘爱医院研究利益冲突政策
查看更多2023-02-08 -
厦弘爱﹝2022﹞91号-厦门弘爱医院临床试验伦理委员会章程
查看更多2023-02-08 -
厦弘爱﹝2022﹞90号-厦门弘爱医院伦理审查体系管理规范
查看更多2023-02-08 -
伦理审查送审指南
查看更多2023-02-08 -
临床试验伦理委员会工作流程
查看更多2023-02-08
受理时间:周一至周五
8:00-12:00 14:00-17:00
受理人:秘书 邱兰秀
联系电话:0592-5261060
邮箱:irb@haxm.com
地址:厦门市湖里区仙岳路3777号门诊楼5楼伦理办公室
邮编:361006
为了保护临床研究受试者的权益和安全,规范医院药物临床试验、医疗器械临床试验的组织管理与运行,保证医疗质量和医疗安全,更好地执行国家发布的《涉及人的生物医学研究伦理审查办法》《药物临床试验质量管理规范》《药物临床试验伦理审查工作指导原则》《医疗器械临床试验质量管理规范》《医疗器械临床试验伦理审查申请与审批表范本》等部门相关法律法规,厦门弘爱医院设立独立的临床试验伦理委员会,全称“厦门弘爱医院临床试验伦理委员会”(以下简称“伦理委员会”)。
伦理委员会对本单位承担的以及本单位以内实施的临床试验进行独立、称职和及时的审查。审查范围包括以注册为目的的药物临床试验项目,医疗器械临床试验项目等。伦理审查类别包括初始审查、跟踪审查和复审。
伦理委员会共有13名委员,其中设有1名主任主任委员会、1名副主任委员会。伦理秘书设有2人。伦理委员会构成符合国家相关法律法规要求,伦理委员会全体人员具有相应伦理审查人员资质。全体成员均已通过国家药品监督管理局高级研修学院举办的药物GCP培训班、医疗器械GCP培训班、临床试验伦理审查培训班、伦理委员会体系文件培训及其他院内外培训,举办一定的伦理审查能力。伦理委员会设置委员会办公室,负责伦理委员会日常行政事务的管理工作。
伦理委员会的宗旨:伦理审查委员会对所有以人作为受试者的临床医学和健康研究项目进行事先的审查、提出修改要求、是否同意开展,对进行中项目的跟踪复审,对研究在科学、伦理和规范方面是否符合国际和国内相关规范和指南发挥监督作用。其宗旨是保护研究受试者的权利和福祉。
- 办事指南 /
- 备案科室介绍 /
- 联系我们